自2003年以来首次美国批准近20年来首款阿尔茨海默症新药过去10年超过100种疗法失败
全球有3000万人受阿尔茨海默症困扰。
美国食品药品监督管理局(FDA)批准阿尔茨海默症(Alzheimer's disease;又译阿兹海默症)新药阿杜卡奴单抗(aducanumab)投入使用,是自2003年以来首次。
由马萨诸塞州剑桥市药企百健(Biogen)研发的阿杜卡奴单抗声称能直接对付阿尔茨海默症的根源,做到“治本”。美国FDA批出许可将为其他国家采用此药提供条件。
按照联合国世界卫生组织(WHO)定义,阿尔茨海默症是最常见的一种痴呆症(dementia)。目前全球有5000万名痴呆症患者,其中阿尔茨海默症患者超过3000万,大多数年龄在65岁以上。
英美两地相关慈善组织纷纷欢迎新药获批的消息。然而,医学界与科研界对阿杜卡奴单抗的看法仍然南辕北辙,一些研究人员对这款药物的临床研究数据有所怀疑。
美国FDA则强调,审查人员已掌握“实质证据证明阿杜卡奴单抗能减少大脑中的淀粉样蛋白斑块(amyloid beta plaques; Aβ plaques)”,局方认为这有望给患者带来“莫大裨 益”。
她曾是芭蕾舞演员,患上了阿兹海默症,而熟悉的《天鹅湖》音乐短暂地唤醒了她的记忆。
https://twitter.com/i/status/1327053590813437959
华文世界对痴呆症(dementia)的不同称呼
- 痴呆症(世界卫生组织)
- 老年痴呆(中国大陆)
- 认知障碍症(香港)
- 失智症(澳门、台湾、新加坡)
在美国,阿尔茨海默症是第六大致死原因。美国阿滋海默症协会(Alzheimer’s Association)预测,到2050年,全国患者将从目前600万人增加至1300万人;英国目前有约50万名患者。
据中国老年保健协会阿尔茨海默病分会文章与官方新华社等报道,中国目前有1000万名阿尔茨海默症患者,预计到2050年,将突破4000万。
受FDA决定鼓舞,百健在美国交易股份价格星期一(6月7日)一度飙升50%,最终收
报每股395.85美元,涨幅38.3%。百健研发伙伴——日本卫材公司——在美交易股份星期一涨56%,收报每股116.03美元。
阿杜卡奴单抗透过对付淀粉样蛋白来阻止大脑组织遭破坏。
阿尔茨海默症持续破坏大脑组织,导致患者丢失记忆,并出现迷失方向等情况,有可能导致患者无法自理日常生活。患者情绪也有可能大起大落,甚或出现沟通困难。
- 记忆与思考障碍
- 沟通障碍
- 感到混乱
2019年3月,阿杜卡奴单抗的晚期全球临床试验突然被叫停。这次试验涉及3000名病人,透过每月一次点滴注射给患者施药。但数据分析显示,新药在减慢记忆衰退与思考障碍方面并不比安慰剂好。
但同年稍后时间,百健声称分析了更多临床数据之后认为,只要提高剂量,阿杜卡奴单抗能有效治疗阿尔茨海默症,包括能显著缓延认知能力下降。
百健声称其开发的阿杜卡奴单抗能对付在大脑形成异常团块的蛋白质——淀粉样蛋白(amyloid)。因为淀粉样蛋白的出现,脑细胞会被破坏,造成痴呆症状,例如:
阿杜卡奴单抗临床试验
68岁英国患者阿尔多·塞雷萨(Aldo Ceresa)本来是外科医生,10年前因为发觉自己无法分辨左右,确诊患上阿尔茨海默症,而被迫离职。
他参与了百健的新药试验,直到试验被叫停为止,他已使用阿杜卡奴单抗达两年。如今他要等待位于伦敦的英国国立神经病学和神经外科医院(National Hospital for Neurology and Neurosurgery)展开另一款药物的临床试验,才有机会获得治疗。
塞雷萨相信阿杜卡奴单抗对其病况带来实质帮助,他的家人也能看到显著改善。
塞雷萨对BBC记者说:“之前我想到厨房里取个什么东西,我都记不住它放在哪里。现在问题没那么大了。”
“我还不至于恢复原有状态,但总算是在朝着正确方向走。”
患者与支援团体的喝彩
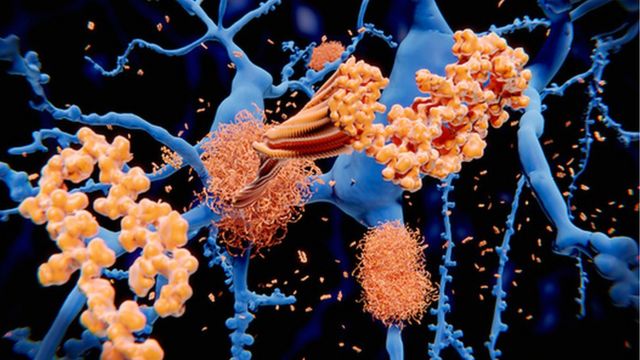
图像来源,Science Photo Library
淀粉样蛋白斑块在脑内积聚会导致神经元遭破坏,造成阿尔茨海默症。
关注阿尔茨海默症团体对美国当局的决定感到鼓舞。
美国阿滋海默症协会在Twitter上说:“我们谨代表受阿尔茨海默症与各种痴呆症影响的患者庆祝今天的历史性决定。”
英国阿尔茨海默症协会(Alzheimer's Society UK)认为,新药给患者带来了希望,但这只是给开发阿尔茨海默症疗法的千里之行踏出第一步。
英国阿尔茨海默症研究会(Alzheimer's Research UK)则表示已去函英国卫生大臣马特·汉考克(Matt Hancock,夏国贤),要求加快英国审批阿杜卡奴单抗进度。总裁希拉里·埃文斯(Hilary Evans)说:“痴呆症患者与他们的家属等待这种改变人生的崭新疗法已经等得太久了。”
传统上,痴呆症疗法研究所得财政资助远低于癌症或心脏病。尽管医学界对阿杜卡奴单抗意见严重分歧,美国当局这次批准采用此药,有望大力提振痴呆症疗法研究。




No comments:
Post a Comment
Note: Only a member of this blog may post a comment.